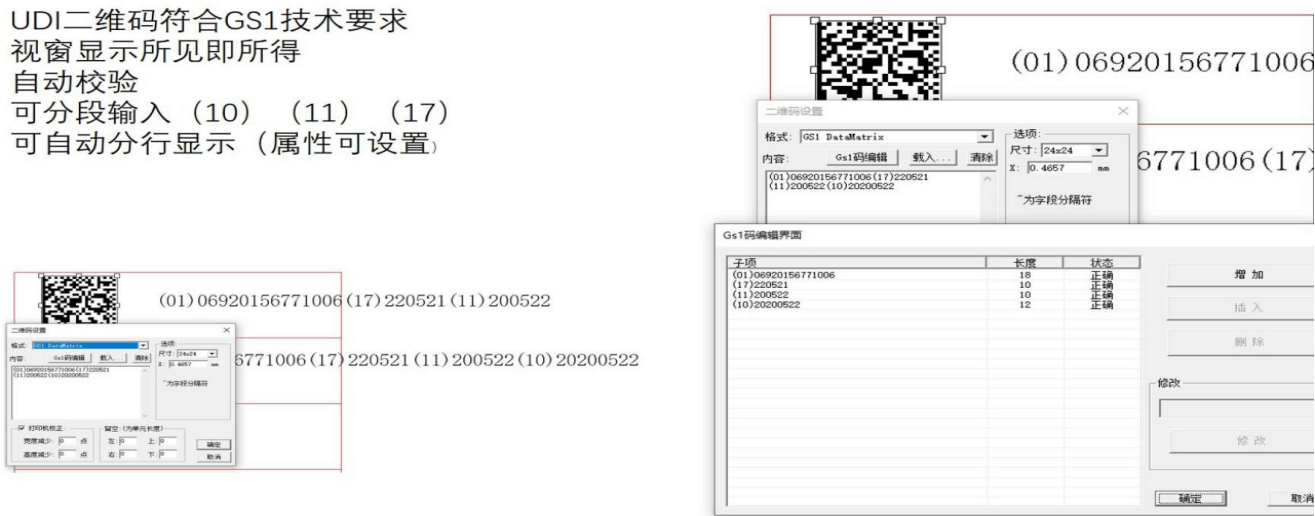
UDI 必须提供人工可读(纯文本)和机器可读两种格式,后者使用自动识别与数据采集 (AIDC) 技术
DI 是UDI 的必须、固定部分,由企业识别码和产品规格码两部分组成。企业识别码由注册人或备案人申请,由符合我国医疗器械编码规则和编码标准的发码机构受理,并分配全球唯一的企业识别码;产品规格码是注册人或备案人根据其生产的产品型号、规格及包装等特征编制的代码。
PI 是医疗器械唯一标识的非必须、可变部分,包括生产日期、失效日期、批号或序列号等。PI 的数据不需要上传编码数据库,所有单位可采用通用扫描设备在本地解析相关生产信息。
UDI 应当符合唯一性、稳定性和可扩展性原则。唯一性是UDI 的首要原则,确保产品的唯一标识不重复是精确识别的基础,也是唯一标识发挥功能的核心原则;稳定性原则要求 UDI 应当与产品基本特征相关,若产品的基本特征未变化, 产品标识应当保持不变;可扩展性原则要求UDI 应当适应监管要求和实际应用的不断发展。


|

|